世界のバイオシミラー市場規模、シェア、動向、COVID-19の影響分析レポート、製品別(組換えヒト成長ホルモン(RHGH)、顆粒球コロニー刺激因子、インターフェロンなど)、製造タイプ別(自社製造、契約製造)、技術別(組換えDNA、モノクローナル抗体)、用途別(オフサイト治療、腫瘍学、慢性疾患、自己免疫疾患など)、地域別(北米、ヨーロッパ、アジア太平洋、ラテンアメリカ、中東、アフリカ)、2021年~2030年の分析と予測
レポートのプレビュー
目次
世界のバイオシミラー市場規模は2021年に176億米ドルと評価され、2030年には564億米ドルに成長し、CAGR 22.80%で成長すると予測されています。これは、Spherical Insights & Consultingによる最新の調査レポートによるものです。
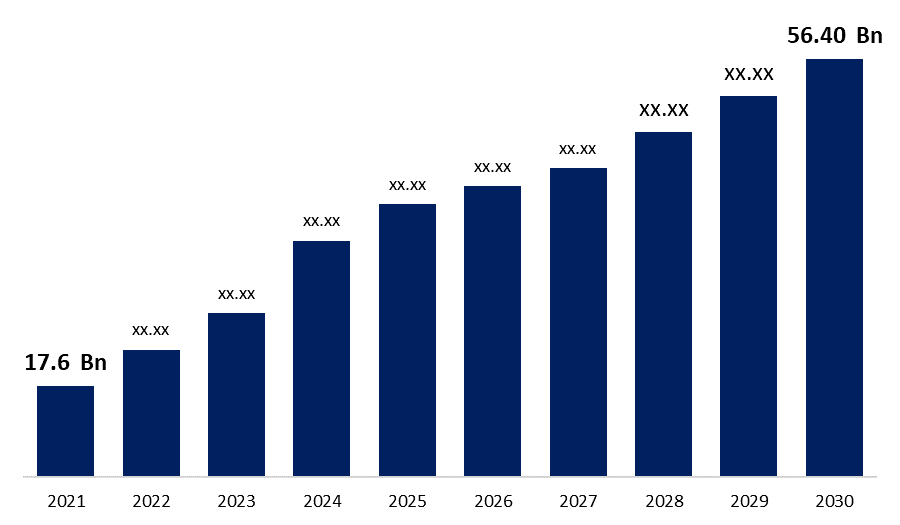
バイオシミラーとは、既に承認されている生物学的製剤(バイオ医薬品)と類似しているものの、同一ではないコピー医薬品です。多くの国の規則では、「類似生物学的製剤」とは、遺伝子工学技術を用いて製造され、安全性、有効性、品質の点で参照生物学的製剤と「類似」であると主張されている生物学的製剤/医薬品を指します。バイオシミラー医薬品は、参照生物学的製剤と類似の有効成分を有し、同じ用量で同じ症状の治療に使用されます。企業ベース(製品プロセスを含む)、規制ベース(迅速試験中)、市場ベースはすべて、バイオシミラー(製造元は同一、商品名は異なる)を表す際に使用される用語です。類似生物学的製剤、フォローアップ生物学的製剤、後続参入生物学的製剤、セカンドエントリー生物学的製剤、バイオジェネティクス、マルチソース製品、特許切れバイオテクノロジー製品はすべてバイオシミラーの同義語です。一般市民や保険会社は費用対効果の高い選択肢を好みますが、バイオシミラーの採用による長期的な経済的影響は調査されていません。バイオシミラー療法の全体的なコストが増加する可能性があります。
196ページにわたる119の市場データ表、図表、チャートを含む主要な業界洞察をレポート「世界のバイオシミラー市場の規模、シェア、トレンド、COVID-19の影響分析レポート、製品別(組換えヒト成長ホルモン(RHGH)、顆粒球コロニー刺激因子、インターフェロンなど)、製造タイプ別(自社製造、契約製造)、技術別(組換えDNA、モノクローナル抗体)、用途別(オフサイト治療、腫瘍学、慢性疾患、自己免疫疾患など)、地域別(北米、ヨーロッパ、アジア太平洋、ラテンアメリカ、中東、アフリカ)、分析と予測2021~2030」 からご覧ください。
バイオシミラーは、特許切れの生物学的製剤と同様に安全かつ有効性を有するように設計された新しいクラスの医薬品です。生物学的製剤の活性タンパク質構造は、急性かつ持続的な免疫反応を引き起こす可能性を高めます。バイオシミラーの全体的なリスクは低いものの、構造の複雑さ、製造方法、そして免疫原性リスクのため、規制手続きが必要となります。
バイオシミラーの課題/限界としては、2つのバイオシミラーの起源が異なる場合、治療効果は同じでも副作用が異なる場合があり、広範な試験が必要となることが挙げられます。多くの生物学的製剤の特許保護期間満了は、バイオシミラー開発の主な推進力となっています。有効成分のサイズと複雑さ、そして製造プロセスの性質上、バイオ医薬品は従来の低分子医薬品とは異なります。製造プロセスにおけるわずかな変更でさえ、致命的な結果(プロセスが製品である)や安全性、有効性の問題につながる可能性があります。
FDAの目的は、「ヒト用医薬品、動物用医薬品、生物学的製剤、医療機器の安全性、有効性、セキュリティを確保することにより、公衆衛生を守ること」です。FDAはバイオシミラーの開発を厳格に規制しており、各申請はFDAによる包括的な評価の対象となります。この評価は、対照となるバイオ医薬品とは別個でありながら、同等に厳格な要件に基づいています。その結果、患者と処方者は、対照となるバイオ医薬品と同等の品質、安全性、有効性を期待できます。対照となるバイオ医薬品の開発と規制上の評価は、一般的に第III相臨床試験データに重点が置かれていますが、バイオシミラーの開発と評価は、差異の検出に最も感度の高い対照となるバイオ医薬品との比較に重点が置かれています。
バイオシミラーの開発は、規制、製造、マーケティングの面で多くの複雑さを伴い、製薬業界で最も費用のかかる開発プロジェクトの一つとなっています。バイオシミラーは、ジェネリック医薬品と同様に、医療費の削減を目的として市場に導入されます。しかし、バイオシミラーの市場参入には、より高いコスト、より大きなリスク、そして臨床開発におけるより多くの時間と専門知識が伴います。さらに、バイオシミラーは、低分子ジェネリック医薬品とは異なるマーケティングおよび発売アプローチを必要とします。FDAの承認取得と製造能力の開発には多大なコストがかかるため、バイオシミラーの競合企業は限られるでしょう。
このような状況では、特定の先発医薬品市場への参入を試みるバイオシミラーメーカーは少数にとどまり、先発医薬品の価格から10%から30%も値引きして販売する可能性は低いでしょう。さらに、バイオシミラーと先行医薬品の間には自動的な代替性がないため、バイオシミラーの市場シェア拡大の速度は緩やかになります。結果として、バイオシミラー研究に必要なリソースの種類と量が、中小企業だけでなく、大手で実績のあるジェネリック医薬品企業や多国籍バイオ医薬品企業にとっても、参入障壁となることは容易に理解できます。85–87 先発医薬品を上回る追加メリットがなく、コスト削減もわずかである場合、バイオシミラーの市場シェア獲得は困難になる可能性があります。多数のバイオシミラーが市場に投入されれば、価格を引き下げることができます。
バイオシミラーは先発医薬品と類似しているにもかかわらず、医師や医療従事者は、これらの医薬品の開発と承認の過程で生じたいくつかの懸念事項、すなわちバイオシミラーの限界を浮き彫りにする懸念事項を認識する必要があります。バイオシミラーの使用は、臨床実践の変革を伴います。パンアメリカン・ヘルス・エデュケーション財団は、患者と医療従事者に対しバイオシミラーの危険性と利点について教育する上で重要な役割を果たすことで、患者の安全性向上に積極的に取り組んでいます。
バイオシミラー製品の安全性、有効性、および品質を確保するため、FDAは互換性のあるバイオシミラーを含むバイオシミラーの承認権限を付与されました。FDAは、2009年生物製剤価格競争・イノベーション法に基づき、既承認医薬品の「バイオシミラー」であるバイオ医薬品の承認のための「短縮された承認手続き」を監視する権限を有しています。この短縮された手順により、動物とヒトの両方におけるバイオシミラー試験の不必要かつ非倫理的な実施を最小限に抑えることができます。これにより、時間、費用、そして人的資源の節約につながります。これは、2010年米国患者保護・医療費負担適正化法によっても支持されています。バイオシミラーの導入には、綿密に策定された医薬品安全性監視戦略が必要です。
バイオシミラーは、生物学的製剤よりも安価であることから、現在、米国、日本、欧州の医薬品市場の大部分を占めています。例えば、欧州では21のバイオシミラーが承認されており、従来の生物学的製剤よりも30%安価です。一方、医師のわずか18%しか、これらの生物学的製剤の差異を認識していません。米国の生物学的製剤特許66件が2022年から2030年の間に失効するため、FDAは2021年にさらに多くのバイオシミラー申請を審査すると予想しており、バイオシミラー事業は大きな成長の瀬戸際にあり、新しい市場を開拓することになります。さらに、これらの医薬品が直面しているパテントクリフは、年間の医薬品売上高が数十億ドルに達すると見込まれています。米国と日本は生物学的製剤への支出が最も多いため、最大かつ最も重要なバイオシミラー市場の中心地になると予想されています。 2021年までに、特許切れの医薬品が市場の少なくとも半分を占めると予測されており、バイオシミラーに大きな成長の機会がもたらされるでしょう。
米国で最初のバイオシミラーが承認されたのは2015年で、2020年には12件のバイオ医薬品特許が満了する予定であり、バイオシミラーは競争的な形でバイオ医薬品ビジネスを席巻すると見込まれます。さらに、2021年までにバイオ医薬品市場の4%から10%をバイオシミラーが占めると予想されています。現在までに米国で最も成功したバイオシミラー(Zarxio)は、米国のフィルグラスチム市場の55%以上を占めています(Hagen, 2020)。一方、バイオシミラーは米国でなかなか受け入れられていません。米国最大の民間医療保険におけるバイオシミラーの適用決定に関する新たな調査によると、バイオシミラーに優先的な適用を認めた決定はわずか14%でした(Chambers et al., 2020)。ヨーロッパは一般的にバイオシミラーの普及率がかなり高く、場合によっては100%に達するとされていますが、この分野におけるヨーロッパの優位性はしばしば誇張されています。一部のヨーロッパ諸国は特定の治療領域においてバイオシミラー市場の高いシェアを占めていますが、バイオシミラーの普及率はヨーロッパ全域および製品クラスによって大きく異なります(IQVIA、2019b)。
2018年には、ヨーロッパ16カ国でフィルグラスチムおよびペグフィルグラスチムのバイオシミラーの90%以上が使用されましたが、アイルランドではわずか27%しか使用されていませんでした(IQVIA、2019b)。抗腫瘍壊死因子バイオシミラー(アダリムマブ、エタネルセプト、インフリキシマブ)の採用率はノルウェーとデンマークでそれぞれ81%と96%と最も高く、その他の国では50%未満でした(IQVIA、2019b)。
セグメンテーション
製品別
- 組み換えヒト成長ホルモン(RHGH)
- 顆粒球コロニー刺激因子
- インターフェロン
- その他
生産タイプ別
- 自社製造
- 契約製造
テクノロジー別
- 組み換えDNA
- モノクローナル抗体
アプリケーション別
- オフサイト処理
- 腫瘍学
- 慢性疾患
- 自己免疫疾患
- その他
地域別
- 北米 – 米国、メキシコ、カナダ
- ヨーロッパ - イギリス、フランス、ドイツ、イタリア、スペイン、その他のヨーロッパ諸国
- アジア太平洋 – 中国、日本、インド、韓国、その他のアジア太平洋地域
- 南米 - ブラジル、アルゼンチン、コロンビア、その他の南米
- 中東およびアフリカ – GCC、南アフリカ、その他の中東およびアフリカ
関連レポート。
世界のナノバイオセンサー市場規模、シェア、トレンド、COVID-19の影響分析レポート、タイプ別(ナノ粒子ベースセンサー、ナノチューブベースセンサー、ナノワイヤベースセンサー)、製品別(ウェアラブルバイオセンサー、非ウェアラブルバイオセンサー)、業界別(ヘルスケア、コンシューマーエレクトロニクス、食品・飲料、航空宇宙・防衛、その他)、地域別(北米、ヨーロッパ、アジア太平洋、ラテンアメリカ、中東、アフリカ)、2021~2030年の分析と予測
世界の短時間作用型インスリン市場規模、シェア、動向、COVID-19の影響分析レポート、薬剤別(アピドラ(グルリジン)、ノボログ/ノボラピッド、ヒューマログ(リスプロ)、ノボリン(アクトラピッド)、インスマン、ヒューマリン、FIASP、アドメログ)および地域別(北米、ヨーロッパ、ラテンアメリカ、アジア太平洋、中東・アフリカ) - 2030年までの市場規模統計と予測
今すぐ購入
15% 無料のカスタマイズ
要件を共有する
私たちは市場でカバーしました
- 24 / 7アナリストサポート
- 世界中のクライアント
- カスタマイズされたインサイト
- テクノロジーの進化
- コンペティティブ・インテリジェンス
- カスタムリサーチ
- シンジケート市場調査
- マーケットスナップショット
- 市場セグメンテーション
- 成長ダイナミクス
- 市場機会
- 規制の概要
- イノベーション&サステナビリティ
 +1-303-800-4326
+1-303-800-4326